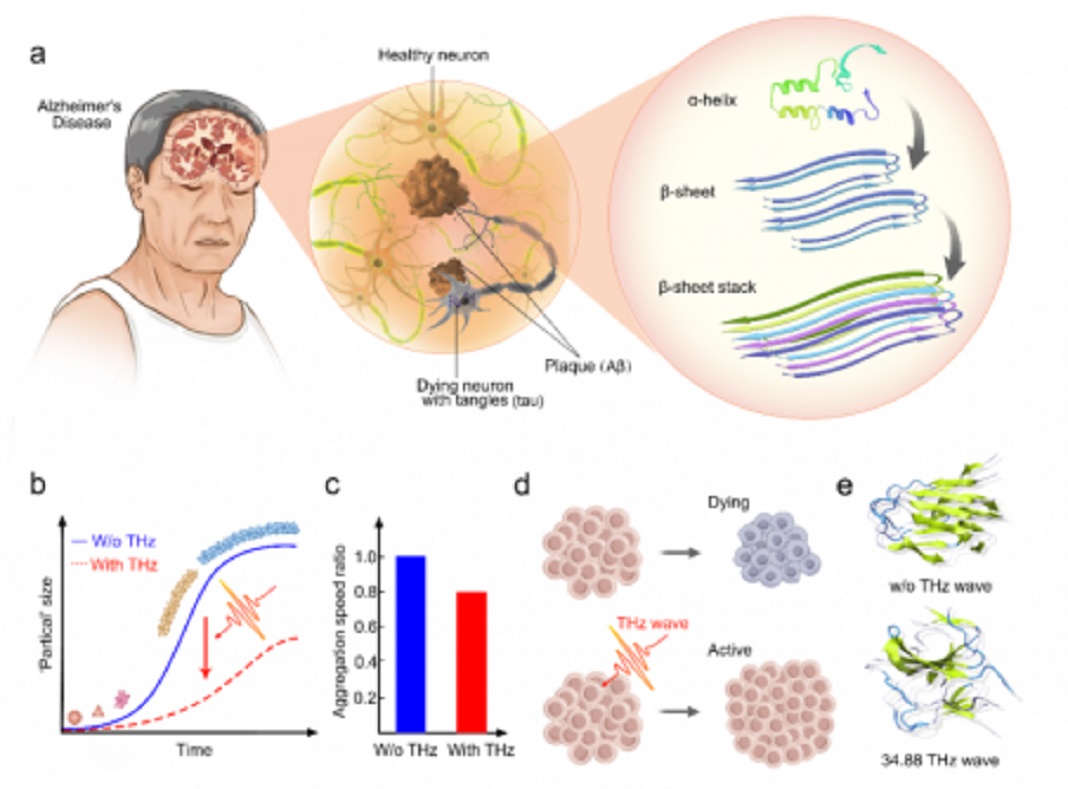
A deposição de amiloide é uma marca registada de doenças neurodegenerativas, como a doença de Alzheimer e a doença de Parkinson. O processo de deposição é descrito como uma curva sigmoidal na qual as proteínas mal dobradas se reúnem-se em oligômeros antes do alongamento da fibrila.
O processo é dinâmico e é acompanhado pelo monômero mal dobrado com mais α-hélice formada em abundante estrutura de folha β reticulada. Ter como alvo o acúmulo tóxico pode representar uma estratégia promissora para retardar ou prevenir o início da doença.
Num novo artigo publicado na “eLight”, uma equipa de cientistas liderada pelo Chao Chang, da Universidade de Pequim, desenvolveu uma técnica única que usa uma frequência específica para regular e minimizar o desenvolvimento da deposição de amiloide.
Foi assente em 2018 que o campo físico dos sinais neurais biológicos pode ser um campo eletromagnético de alta frequência que varia de terahertz (THz) a infravermelho (IR). É mais provável que varie de 0,5 a 100 THz e é chamada onda eletromagnética THz generalizada.
Alguns processos fisiológicos foram comprovados, como o desenrolamento dos grampos de cabelo do ADN, a permeabilidade do canal de cálcio dependente de voltagem e as correntes de K+ dependentes de voltagem podem fazer a sua regulação.
Para os cientistas seria essencial prevenir ou mitigar a patologia da doença de Alzheimer se as características ressonantes pudessem ser exploradas para modular o processo de automontagem e evitar a agregação indesejada de proteínas.
Um estudo anterior descobriu que uma luz de 50,25 THz poderia dissociar as fibrilas amiloides por uma experiencia conjunta de laser de eletrões livres e método de simulação de dinâmica molecular. Houve um efeito térmico significativo nesta frequência porque o líquido biológico tem uma forte absorção na faixa de 45-52,5 THz. Isso faz com que a eficiência regulada no ambiente fisiológico seja consideravelmente enfraquecida. Portanto, é urgente explorar métodos não térmicos e eficientes para inibir o processo de agregação de Aβ.
A equipe de pesquisa usou o amiloide β (Aβ) como exemplo para conduzir o estudo, e não afirma que Aβ desempenha o papel determinante no desenvolvimento da doença de Alzheimer, então mais estudos começaram a enfatizar a importância da proteína tau. As proteínas amiloides têm processos de agregação dinâmicos semelhantes. Ainda não existem medicamentos eficazes que possam inibir ou aliviar a deterioração da patologia da doença de Alzheimer.
O estudo pretende regular as conformações de proteínas patológicas por meios óticos que intervêm no processo dinâmico. Esta investigação baseada em Aβ pode ser aplicada posteriormente à proteína tau, que é de grande importância para o desenvolvimento da terapia combinada.
A equipa de investigação usou o laser de cascata quântica (QCL) com uma frequência central de 34,88 THz (8,6 µm) para irradiar os oligômeros Aβ1-42. Eles monitoraram o processo de fibrose por ensaio de ligação de tioflavina T (ThT) e espectrómetro de infravermelho por transformada de Fourier (FTIR). A equipa de investigação descobriu que o processo de fibrose diminuiu significativamente em comparação com o grupo sem campo externo. A segurança dessa frequência no nível celular também foi detetada por meio de ensaios de viabilidade celular e potencial de membrana mitocondrial.
Pode-se observar que as células proliferaram significativamente, e houve um leve aumento do potencial de membrana mitocondrial. Isso demonstra que as ondas THz podem afetar positivamente a função das células. Os cientistas também encontraram uma mudança significativa na conformação da proteína, que passa da estrutura regularmente ordenada para uma estrutura desordenada, especificamente, com mais estrutura de folha β transformada na região da bobina e dobra. As ondas THz podem ser uma estratégia promissora para retardar o processo de fibrilação amiloide.