O Prémio Nobel de Medicina de 2024 homenageia dois cientistas pela descoberta de um princípio fundamental que rege a regulação da atividade genética.
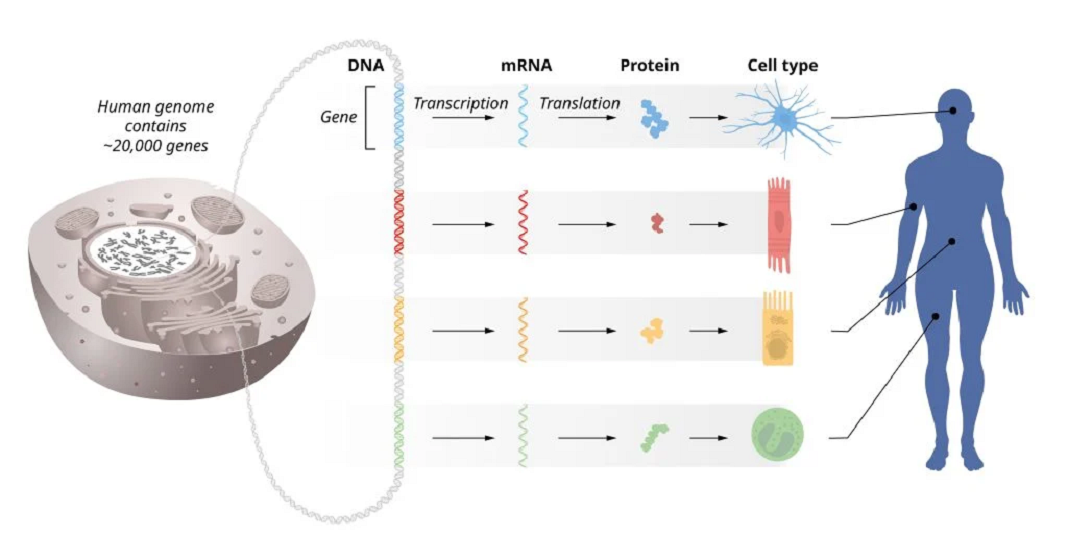
As informações armazenadas em nos nossos cromossomos podem ser comparadas a um manual de instruções para todas as células do nosso corpo. Cada célula contém os mesmos cromossomos, então cada célula contém exatamente o mesmo conjunto de genes e exatamente o mesmo conjunto de instruções. No entanto, diferentes tipos de células, como células musculares e nervosas, têm características muito distintas. Como essas diferenças surgem? A resposta está na regulação genética, que permite que cada célula selecione apenas as instruções relevantes. Isso garante que apenas o conjunto correto de genes esteja ativo em cada tipo de célula.
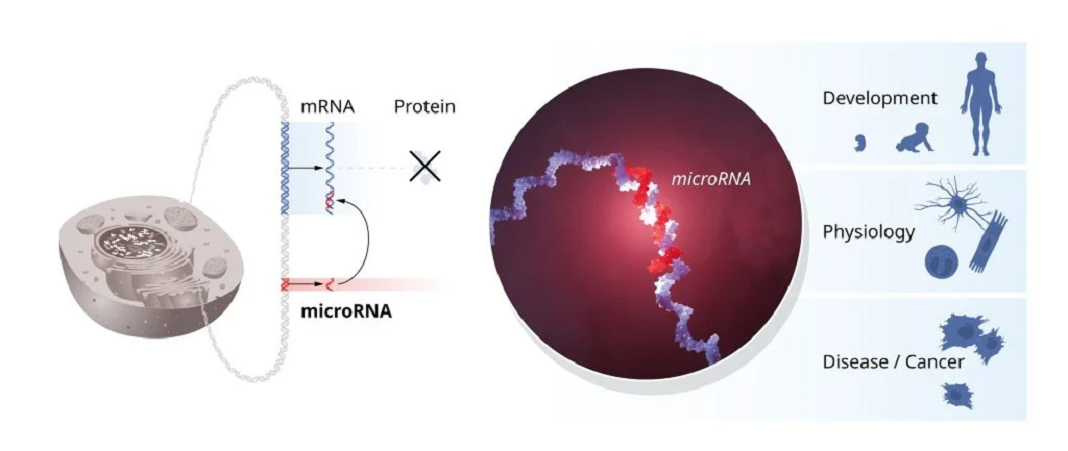
Victor Ambros e Gary Ruvkun estavam interessados em como diferentes tipos de células se desenvolvem. Eles descobriram o microRNA, uma nova classe de pequenas moléculas de RNA que desempenham um papel crucial na regulação genética. A sua descoberta inovadora revelou um princípio completamente novo de regulação genética que se mostrou essencial para organismos multicelulares, incluindo humanos. Agora sabe-se que o genoma humano codifica mais de mil microRNAs. Uma descoberta surpreendente revelou uma dimensão inteiramente nova para a regulação genética. Os microRNAs estão a mostrar-se de fundamentalmente importantes para como os organismos se desenvolvem e funcionam.
Regulação essencial
O Prémio Nobel de 2024 concentra-se na descoberta de um mecanismo regulador vital usado em células para controlar a atividade genética. A informação genética flui do DNA para o RNA mensageiro (mRNA), por meio de um processo chamado transcrição, e depois para a maquinaria celular para produção de proteína. Lá, os mRNAs são traduzidos para que as proteínas sejam feitas de acordo com as instruções genéticas armazenadas no DNA. Desde meados do século XX, várias descobertas científicas, mais fundamentais, explicaram como esses processos funcionam.
Os nossos órgãos e tecidos consistem em muitos tipos diferentes de células, todas com informações genéticas idênticas armazenadas no seu DNA. No entanto, essas diferentes células expressam conjuntos únicos de proteínas. Como isso é possível? A resposta está na regulação precisa da atividade genética para que apenas o conjunto correto de genes esteja ativo em cada tipo específico de célula. Isso permite, por exemplo, que células musculares, células intestinais e diferentes tipos de células nervosas desempenhem suas funções especializadas. Além disso, a atividade genética deve ser continuamente ajustada para adaptar as funções celulares às condições de mudança em nossos corpos e ambiente. Se a regulação genética não for a correta, isso pode levar a doenças graves, como cancro, diabetes ou autoimunidade. Portanto, entender a regulação da atividade genética tem sido uma meta importante durante muitas décadas.
Na década de 1960, foi demonstrado que proteínas especializadas, conhecidas como fatores de transcrição, podem ligar-se a regiões específicas no DNA e controlar o fluxo de informações genéticas determinando quais os mRNAs que são produzidos. Desde então, milhares de fatores de transcrição foram identificados e, durante muito tempo, acreditou-se que os principais princípios da regulação genética tinham sido resolvidos. No entanto, em 1993, os laureados do Nobel de 2024 publicaram descobertas inesperadas descrevendo um novo nível de regulação genética, que se mostrou altamente significativo e conservado ao longo da evolução.
Investigação sobre um pequeno verme leva a um grande avanço
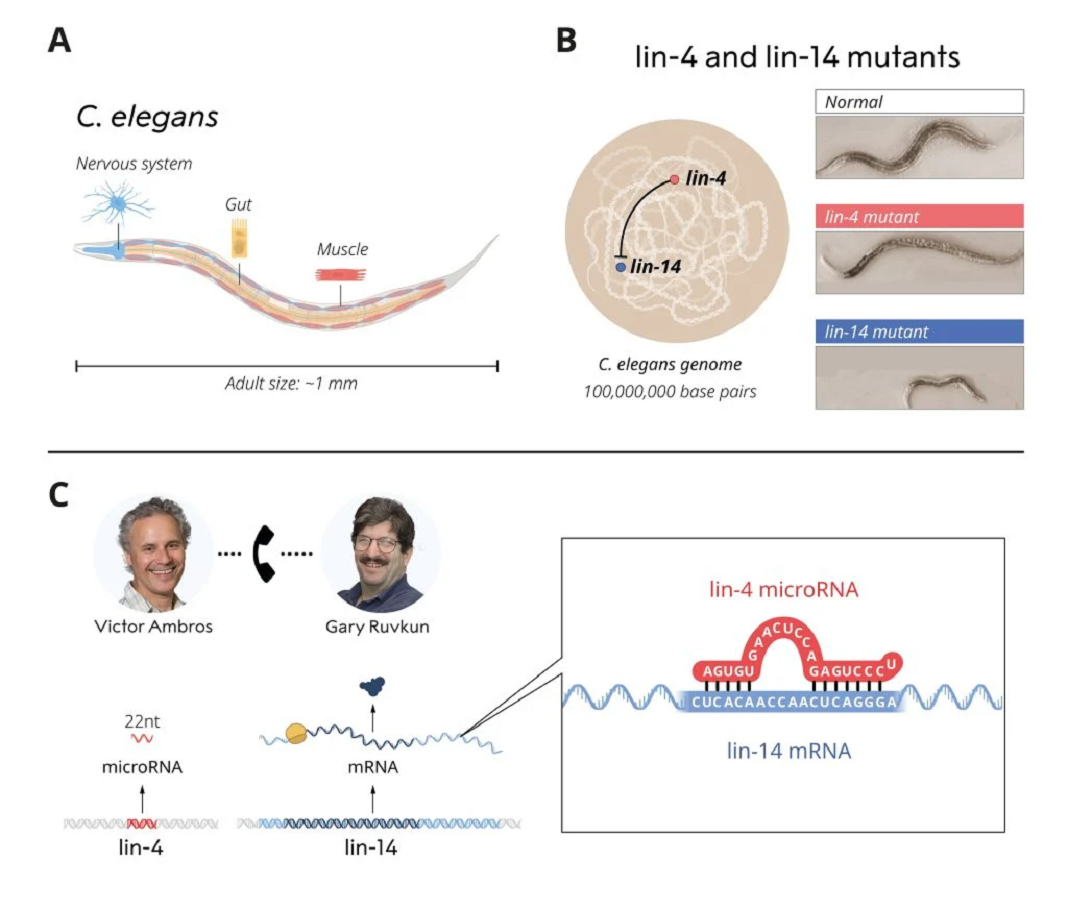
No final da década de 1980, Victor Ambros e Gary Ruvkun eram bolseiros de pós-doutoramento no Laboratório de Robert Horvitz, que recebeu o Prémio Nobel em 2002, ao lado de Sydney Brenner e John Sulston. No laboratório de Horvitz estudaram um verme redondo relativamente modesto de 1 mm de comprimento, C. elegans. Apesar de seu tamanho pequeno, C. elegans possui muitos tipos de células especializadas, como células nervosas e musculares, também encontradas em animais maiores e mais complexos, tornando-o um modelo útil para investigar como os tecidos se desenvolvem e amadurecem em organismos multicelulares.
Ambros e Ruvkun estavam interessados em genes que controlam o tempo de ativação de diferentes programas genéticos, garantindo que vários tipos de células se desenvolvam no momento certo. Eles estudaram duas linhagens mutantes de vermes, lin-4 e lin-14, que apresentavam defeitos no tempo de ativação de programas genéticos durante o desenvolvimento.
Os laureados queriam identificar os genes mutados e entender a sua função. Ambros tinha mostrado anteriormente que o gene lin-4 parecia ser um regulador negativo do gene lin-14. No entanto, como a atividade do lin-14 era bloqueada era desconhecido. Ambros e Ruvkun ficaram intrigados com esses mutantes e o seu relacionamento potencial e partiram para resolver esses mistérios.
Após a investigação de pós-doutoramento, Victor Ambros analisou o mutante lin-4 no laboratório recém-estabelecido na Universidade de Harvard. O mapeamento metódico permitiu a clonagem do gene e levou a uma descoberta inesperada. O gene lin-4 produziu uma molécula de RNA anormalmente curta que não tinha um código para a produção de proteína. Esses resultados surpreendentes sugeriram que esse pequeno RNA do lin-4 era responsável por inibir o lin-14. Mas como é que isso pode funcionar?
Ao mesmo tempo, Gary Ruvkun investigou a regulação do gene lin-14 no laboratório recém-estabelecido no Massachusetts General Hospital e na Harvard Medical School. Ao contrário de como a regulação genética era então conhecida por funcionar, Ruvkun mostrou que não é a produção de mRNA a partir de lin-14 que é inibida por lin-4. A regulação pareceu ocorrer em um estágio posterior no processo de expressão genética, por meio do desligamento da produção de proteínas. Os experimentos também revelaram um segmento no mRNA de lin-14 que era necessário para sua inibição por lin-4.
Os dois laureados compararam as suas descobertas, o que resultou numa descoberta inovadora. A curta sequência de lin-4 correspondia a sequências complementares no segmento crítico do mRNA de lin-14. Ambros e Ruvkun realizaram outras experiencias mostrando que o microRNA de lin-4 desliga o lin-14 ao se ligar às sequências complementares no mRNA, bloqueando a produção da proteína lin-14. Um novo princípio de regulação genética, mediado por um tipo de RNA até então desconhecido, o microRNA, foi descoberto! Os resultados foram publicados em 1993 em dois artigos na revista Cell.
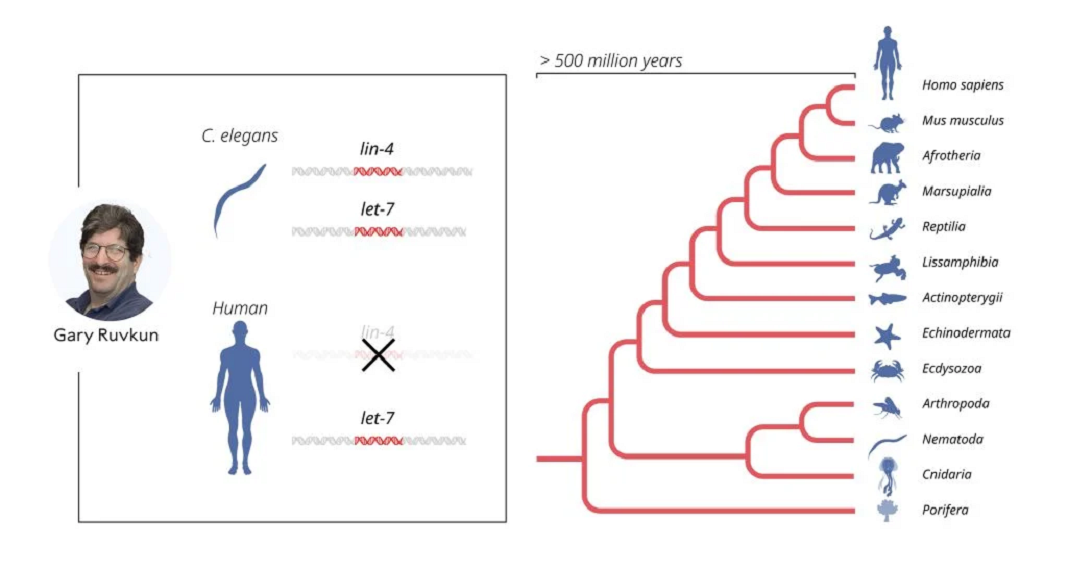
Os resultados publicados foram inicialmente recebidos com um silêncio quase ensurdecedor da comunidade científica. Embora os resultados fossem interessantes, o mecanismo incomum de regulação genética foi considerado uma peculiaridade de C. elegans, provavelmente irrelevante para humanos e outros animais mais complexos. Essa perceção mudou em 2000, quando o grupo de investigação de Ruvkun publicou sua descoberta de outro microRNA, codificado pelo gene let-7. Ao contrário do lin-4, o gene let-7 era altamente conservado e presente em todo o reino animal. O artigo despertou grande interesse e, nos anos seguintes, centenas de microRNAs diferentes foram identificados. Hoje, sabemos que em humanos há mais de mil genes para diferentes microRNAs e que a regulação genética por microRNA é universal entre organismos multicelulares.
Além do mapeamento de novos microRNAs, experiências levadas a cabo por vários grupos de investigação elucidaram os mecanismos de como os microRNAs são produzidos e entregues a sequências-alvo complementares em mRNAs regulados. A ligação do microRNA leva à inibição da síntese de proteínas ou à degradação do mRNA. Curiosamente, um único microRNA pode regular a expressão de muitos genes diferentes e, inversamente, um único gene pode ser regulado por vários microRNAs, coordenando e ajustando redes inteiras de genes.
A maquinaria celular para produzir microRNAs funcionais também é empregue para produzir outras pequenas moléculas de RNA em plantas e animais, por exemplo, como um meio de proteger plantas contra infeções por vírus. Andrew Z. Fire e Craig C. Mello, galardoados com o Prémio Nobel em 2006, descreveram a interferência de RNA, onde moléculas específicas de mRNA são inativadas pela adição de RNA fita dupla às células.
Pequenos RNAs com profunda importância fisiológica
A regulação genética por microRNA, revelada pela primeira vez por Ambros e Ruvkun, está em ação há centenas de milhões de anos. Esse mecanismo permitiu a evolução de organismos cada vez mais complexos. Sabemos por pesquisas genéticas que células e tecidos não se desenvolvem normalmente sem microRNAs. A regulação anormal por microRNA pode contribuir para o cancro, e mutações em genes que codificam microRNAs foram encontradas em humanos, causando condições como perda auditiva congénita, distúrbios oculares e esqueléticos. Mutações em uma das proteínas necessárias para a produção de microRNA resultam na síndrome DICER1, uma síndrome rara, mas grave, associada ao cancro em vários órgãos e tecidos.
A descoberta seminal de Ambros e Ruvkun no pequeno verme C. elegans foi inesperada e revelou uma nova dimensão na regulação genética, essencial para todas as formas de vida complexas.