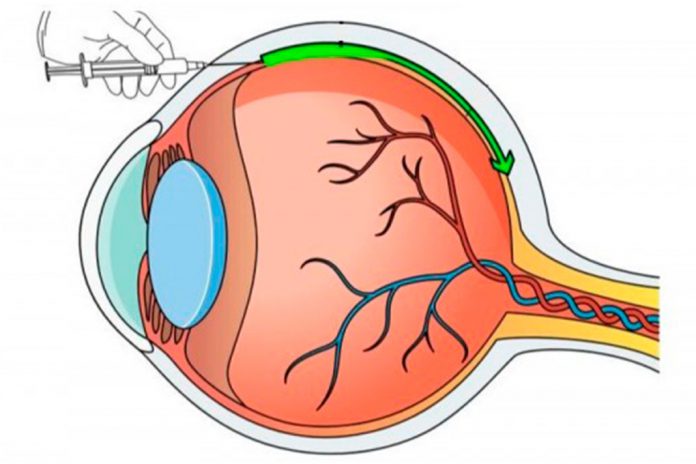
Uma série de doenças oculares tem vindo a beneficiar de terapias genéticas em que o DNA que codifica as proteínas terapêuticas é entregue às células do olho. As terapias atuais entregam o DNA usando vetores virais, mas esse método tem limitações, incluindo o desenvolvimento de uma resposta imune contra o portador viral e limites para o tamanho do gene que pode caber no vírus.
Engenheiros e oftalmologistas, com o apoio do Instituto Nacional de Imagem Biomédica e Bioengenharia, EUA, uniram-se para abordar as limitações dos vetores virais no tratamento de doenças oculares que causam cegueira, como degeneração macular relacionada à idade húmida (DMRI). A DMRI húmida (ou degeneração macular exsudativa) é uma doença comum caracterizada pelo crescimento anormal dos vasos sanguíneos que danifica o tecido sensível à luz na parte posterior do olho.
A equipa de investigação da Escola de Medicina da Universidade Johns Hopkins foi liderada por Jordan Green, investigador de Engenharia Biomédica, Oftalmologia, Oncologia, Neurocirurgia, Ciência e Engenharia de Materiais e Engenharia Química e Biomolecular, e Peter A. Campochiaro, Diretor do Laboratório de Células Retinais e Molecular e George S. & Dolores Dor Eccles investigador de Oftalmologia e Neurociência.
“Esta é uma excelente colaboração que combina o trabalho do Dr. Green na criação de nanopartículas para entrega de genes e a experiência do Dr. Campochiaro em doenças da retina”, referiu David Rampulla, Diretor do programa do Instituto Nacional de Imagem Biomédica e Bioengenharia em Sistemas Biológicos e Biomiméticos Sintéticos. “O sistema que eles criaram promete reduzir os efeitos debilitantes das doenças oculares e preservar a visão, inibindo a progressão da doença.”
“Fomos capazes de usar a terapia genética para tratar doenças oculares porque o olho é muito acessível e capta os vírus que carregam o gene terapêutico com bastante facilidade”, explicou Peter A. Campochiaro. “No entanto, a expressão da proteína terapêutica eventualmente desaparece, exigindo injeções repetidas do vírus portador do gene para manter níveis adequados da proteína terapêutica.”
Os tratamentos repetidos são problemáticos porque significam injeções frequentes nos olhos dos pacientes. E estas repetidas injeções não têm sucesso porque o sistema imunológico do paciente desenvolveu anticorpos que atacam e neutralizam o vírus portador do gene.
É aí que entra a tecnologia de nanopartículas de Jordan Green. As nanopartículas são virtualmente não detetadas pelo sistema imunológico e não há desenvolvimento aparente de anticorpos que atacariam a partícula num tratamento subsequente. Outra característica desejável é que as nanopartículas podem transportar genes terapêuticos que são muito grandes para serem transportados por vetores virais.
Os investigadores realizaram uma série de experiências em ratos, e mostraram que as nanopartículas transportavam genes de forma muito eficiente para as células do olho e produziam grandes quantidades de proteínas. As proteínas continuaram a ser produzidas durante pelo menos oito meses, uma melhora significativa em relação aos tratamentos atuais, em que as proteínas terapêuticas devem ser injetadas diretamente a cada 1 a 2 meses.
Foi realizado um teste usando um gene que produz o fator de crescimento endotelial vascular (VEGF, sigla em inglês). Este VEGF induz o crescimento de novos vasos sanguíneos no olho. Se houver muito VEGF, haverá uma superprodução de vasos sanguíneos que se estendem para a retina e bloqueiam a visão, que é o que acontece em pessoas com DMRI húmida.
Os investigadores injetaram nos olhos de 30 ratos as nanopartículas contendo o gene VEGF. Os ratos desenvolveram vasos sanguíneos anormais um mês após a injeção. Os vasos sanguíneos anormais eram mais extensos dois e cinco meses após a injeção, e havia cicatrizes sob a retina semelhantes às observadas em pacientes com DMRI húmida não tratada. Isso validou a eficácia e durabilidade do sistema de terapia génica para a criação de modelos animais.
No artigo publicado no Science Advances é referido que o potencial terapêutico do sistema de entrega foi testado pela entrega de uma nanopartícula carregando um gene que produz uma proteína que inibe VEGF.
A nanopartícula inibidora foi injetada num modelo de rato com DMRI húmida, que apresentava a superprodução de vasos sanguíneos anormais vistos na doença em humanos. Três semanas após a injeção de nanopartículas contendo o gene para a proteína inibidora do VEGF, os ratos tiveram uma redução de 60% nos vasos sanguíneos anormais quando comparados aos ratos de controlo.
“Estes resultados são extremamente promissores”, referiu Jordan Green. “Mostramos que as nanopartículas têm potencial para entregar genes que produzem proteínas terapêuticas ativas durante muitos meses. O resultado é uma melhoria considerável em relação à terapia atual de injeção direta da proteína terapêutica, que requer injeções repetidas durantes meses. A falta de uma resposta imune aparente às nanopartículas também é uma melhoria significativa em relação à terapia genética com vetores virais.”
A equipa de investigadores está agora a trabalhar no uso do sistema de nanopartículas para tratar pacientes com visão reduzida ou sem visão devido a defeitos genéticos onde a cegueira ocorre por causa de um gene defeituoso herdado. Os investigadores estão com esperança de que a robusta expressão do gene vista com suas nanopartículas lhes permitirá introduzir versões funcionais de genes que mutações herdadas desativaram – e restaurar a visão.